|
|
||
|
|
||
|
|
||||||||||
|
||||||||||
 |
||||||||||
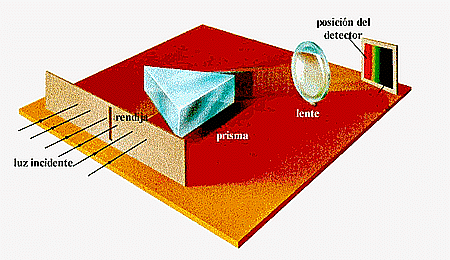
| Figura 2-2-1: Espectrógrafo | ||||||||||
|
Cuando la luz pasa a través de un prisma se descompone en bandas de colores como el arco iris. Así la "luz blanca" se compone de todos los colores del arco iris y en un cierto orden que siempre es el mismo, rojo, anaranjado, amarillo, verde, azul, índigo y violeta (Figura 2-2-1). Podemos entender porque la luz contiene los diferentes colores si pensamos que la luz son ondas electromagnéticas que viajan a la velocidad de 300 000 km/s, este valor se conoce como la velocidad de la luz. La distancia entre dos crestas sucesivas de la onda se denomina la longitud de onda. Luz de diferentes longitudes de onda aparece como de diferentes colores. La luz roja tiene una vez y media la longitud de onda de la luz azul y la luz amarilla tiene una longitud de onda intermedia entre las dos. |
|
|||||||||
|
Las longitudes de onda de la luz son muy cortas, unas pocas centésimas o milésimas de un centímetro, por ello los astrónomos usan una unidad de longitud de onda llamada Angstrom, 1 Å es 10-8 cm o bien en nanometros (1nm = 10-9m) 1 Å es 10-1 nm. Por ejemplo: la longitud de onda de la luz violeta es aproximadamente 4000 Å , y la de la amarilla 6000 Å . El ojo no es sensible a radiaciones de longitud de onda más corta que 4000 Å ni más larga que 6500 Å pero hay instrumentos que pueden medir la luz a más cortas y mas largas longitudes de onda. La radiación más corta que el violeta es la ultravioleta y rayos X, a longitudes mayores que el rojo está el infrarrojo, y las radio ondas. Desde un punto de vista científico no hay diferencias cualitativas reales entre las radiaciones de diferentes longitudes de onda, se denominan ondas electromagnéticas y las ondas de luz están comprendidas en un rango limitado. Cuando una onda electromagnética tiene una longitud de 1Å , se llama rayos X. Cuando tiene 5 000 Å la llamamos luz y cuando tiene una longitud de onda de 1 cm se denomina radio onda. Naturalmente hay diferencia en el método de detectar estas radiaciones pero el principio que gobierna su existencia es el mismo. |
||||||||||
|
El primero que mostró que la luz del Sol contenía los colores del arco iris fué Newton en 1666, más tarde Fraunhofer en 1811 estudió la luz del Sol haciéndola atravesar un prisma y vió que se descomponía en colores pero que en ciertos colores había huecos que parecian líneas oscuras. Estos huecos se llaman líneas espectrales y el fondo de colores sobre el que se superponen los huecos se denomina el espectro continuo. Las líneas oscuras del espectro del Sol, y del espectro de la mayoría de las estrellas, representan una disminución de la radiación electromagnética a unas longitudes de onda particulares y se denominaba líneas de absorción. También es posible que a ciertas longitudes de onda a veces haya más radiación que en las longitudes de onda próximas, apareciendo como huecos brillantes, reciben entonces el nombre de líneas de emisión. El químico alemán Gustav Kirchhoff descubrió en 1859 que las líneas espectrales pueden explicarse como la absorción o emisión de energía, a una determinada longitud de onda, producida por los átomos de un elemento químico que se encuentra en estado gaseoso. Un átomo está constituido por un núcleo rodeado de partículas orbitantes, llamadas electrones. Las partículas del núcleo son los protones que tienen una unidad de carga eléctrica positiva, y los neutrones que no tienen carga eléctrica. Los electrones tienen una unidad de carga eléctrica negativa y son 1800 veces menos masivos que los protones o los neutrones. Según la mecánica cuántica un átomo sólo puede tener ciertos valores discretos de energía, es decir, no son posibles todos los valores de la energía, se dice que los estados de energía de un átomo están cuantificados. |
||||||||||
|
Cuando un átomo pasa de un estado de energía superior a uno inferior, la diferencia de energía entre los dos estados es emitida en forma de radiación, llamada también fotones. Un fotón se considera como una partícula de radiación electromagnética y de aquí la doble dualidad de la luz (y toda la radiación electromagnética) que tiene propiedades de ondas en algunas circunstancias y propiedades de partículas bajo otras circunstancias. Los fotones naturalmente viajan a la velocidad de la luz. Una relación entre la dualidad onda corpúsculo de la luz se ve claramente en la relación entre la energía del fotón (partícula),E, y su longitud de onda (onda),l, E = h c/l = h n donde h es la constante de Planck (6.6256 x 10-34 J), c la velocidad de la luz (300 000 km. s-1) y n es la frecuencia de la radiación que es inversamente proporcional a la longitud de onda, n = c/l. Un fotón muy energético, por ejemplo un fotón de rayos X, tiene una longitud de onda muy pequeña, 1 Å, un fotón de luz visible tiene menos energía pero una longitud de onda mayor, 5000 Å . |
|
|||||||||
|
Cuando se calienta un gas sus átomos se encuentran en estados de energía superiores al estado más bajo de energía posible (llamado estado fundamental), se dice que los átomos están excitados. Pero los átomos sólo pueden permanecer en estados excitados un cierto tiempo, llamado vida media, al cabo del cual espontáneamente se desexcitan pasando al fundamental y emitiendo fotones. Estos fotones representan energía a ciertas longitudes de onda que corresponde en el espectro a longitudes de onda brillantes, es decir, líneas de emisión. |
||||||||||
|
Cuando la radiación continua (energía emitida a todas las longitudes de onda o frecuencias) de un cuerpo a una temperatura alta, pasa a través de un gas frío, los átomos constituyentes del gas atrapan energía de la radiación continua y se excitan a estados superiores de energía. En el espectro observamos menos energía, la robada por los átomos, a ciertas longitudes de onda, son las líneas de absorción que en el visible aparecen como líneas oscuras. Las líneas de absorción no pueden formarse sin que exista una fuente que emita un continuo ( radiación continua), por el contrario las de emisión sí. Cuando suministramos energía a un átomo y se excita, uno o más de sus electrones orbitales pasa a un nivel superior de energía, puede ocurrir que la energía suministrada se tal que permita al electrón escaparse del átomo. Cuando ocurre esto decimos que el átomo se ioniza y el remanente que queda, un átomo con menos electrones, recibe el nombre de ión. Si sólo pierde un electrón se dice un átomo una vez ionizado, si pierde dos electrones es un átomo dos veces ionizado y así sucesivamente. Resumiendo lo anterior podemos decir que: sí un vapor de un elemento cualquiera se calienta, produce un conjunto característico de líneas de emisión, que ese elemento y sólo él posee esas líneas espectrales específicas. Por otro lado, si un espectro continuo radiado por una fuente de energía a alta temperatura pasa a través de un vapor frío de cualquier elemento, aparece un conjunto de líneas de absorción superpuestas al espectro continuo y estas líneas de absorción tienen las mismas longitudes de onda características de las líneas de emisión de ese elemento químico. Así el vapor de un elemento a través del que ha pasado la luz ha substraído energía del espectro continuo a las longitudes de onda que son propias del elemento. Sí un espectro continuo pasa a través de un vapor de un elemento y después a través de otro vapor de un elemento diferente, o a través de una mezcla de los dos gases, el espectro de absorción que resulta muestra las líneas de absorción características de ambos elementos. El espectro de la mayoría de las estrellas muestra un continuo y superpuestas líneas de absorción que corresponden a los mismos elementos que se observan en el laboratorio, luego estos son los constituyentes de las capas exteriores de las estrella, que absorben la radiación continua generada en el interior de la estrella, y producen la formación de las líneas de absorción. El espectro de absorción de una estrella sirve pues a identificar los elementos químicos constituyentes de su atmósfera, ya que cada elemento produce sus propias líneas de absorción. Si un elemento químico está presente en gran cantidad sus líneas espectrales características serán muy intensas, pero la observación del espectro sólo nos indica los elementos presentes pero no sus abundancias relativas, ya que la intensidad de las líneas depende no sólo de la abundancia sino también de la temperatura a la que se encuentra el elemento que produce la absorción, la observación de los espectros estelares puede suministrar información sobre la temperatura y otras condiciones físicas de las atmósferas estelares. |
|
|||||||||
|
|
||||||||||